 Введение
Введение
Заболевание COVID-19 сопровождается нарушением регуляции иммунного ответа и гиперкоагуляцией. Стационарное исследование Anti Coronavirus Therapies (ACT) было направлено на оценку противовоспалительной терапии колхицином и антитромботической терапии комбинацией ривароксабана и аспирина для предотвращения прогрессирования заболевания у пациентов, госпитализированных по поводу инфекции COVID-19.
Методы
Стационарное открытое рандомизированное контролируемое исследование ACT с факториальным дизайном 2×2 было проведено в 62 клинических центрах в 11 странах. Пациенты в возрасте как минимум 18 лет с симптомами лабораторно подтвержденного COVID-19 в течение 72 часов после госпитализации или при клиническом ухудшении, если уже были госпитализированы, были рандомизированы (1: 1) на прием колхицина в дозе 1,2 мг, затем 0,6 мг через 2 часа, а затем 0,6 мг два раза в день в течение 28 дней по сравнению со стандартной терапией; и во второй рандомизации (1:1) на прием комбинации ривароксабана 2,5 мг два раза в день с аспирином 100 мг один раз в день в течение 28 дней по сравнению со стандартной терапией.
Результаты рандомизации не были заслеплены ни для исследователей, ни для пациентов. Первичной конечной точкой, которая оценивалась через 45 дней в популяции, имевшей намерение лечиться, для рандомизации с применением колхицина явилась совокупность потребности в оксигенотерапии, искусственной вентиляции легких или смерть; а для рандомизации с применением комбинации ривароксабана с аспирином — совокупность значимых тромбозов (инфаркт миокарда, инсульт, острая ишемия нижних конечностей или ТЭЛА), потребность в оксигенотерапии, искусственной вентиляции легких, или смерть.
Результаты
В период со 2 октября 2020 года по 10 февраля 2022 года в 62 центрах в 11 странах 2749 пациентов были случайным образом распределены на колхицин или контрольную группу и комбинацию ривароксабана и аспирина или контрольную группу. 2611 пациентов были включены в анализ колхицина (n=1304) по сравнению с контролем (n=1307); 2119 пациентов были включены в анализ ривароксабана и аспирина (n=1063) по сравнению с контролем (n=1056).
Последующее наблюдение было завершено более чем на 98%. В целом, 368 (28,2%) из 1304 пациентов, которым был назначен колхицин, и 356 (27,2%) из 1307 пациентов из контрольной группы, достигли событий первичной конечной точки (отношение рисков [ОР] 1,04, 95% ДИ 0,90−1,21, p=0,58); и 281 (26,4%) из 1063 пациентов, которым назначалась комбинация ривароксабана и аспирина, и 300 (28,4%) из 1056 пациентов из контрольной группы достигли событий первичной конечной точки (ОР 0,92, 95% ДИ 0,78−1,09, p=0,32).
Результаты были одинаковыми в подгруппах, определяемых статусом вакцинации, тяжестью заболевания на исходном этапе и временем рандомизации в зависимости от появления симптомов. Не было отмечено увеличения числа пациентов, у которых было по крайней мере одно серьезное нежелательное явление при применении колхицина по сравнению с контрольными группами (87 [6,7%] из 1304 против 90 [6,9%] из 1307) или ривароксабана и аспирина по сравнению с контрольными группами (85 [8,0%] против 91 [8,6%]).
Среди пациентов, которым был назначен колхицин, у 8 (0,61%) были побочные явления, которые привели к прекращению приема исследуемого препарата, в основном желудочно-кишечного характера. У 17 (1,6%) пациентов, которым была назначена комбинация ривароксабана и аспирина, было отмечено кровотечение по сравнению с 7 (0,66%) из тех, кто был отнесен к контрольной группе (р=0,042); количество серьезных кровотечений составило 2 (0,19%) против 6 (0,57%) соответственно (р=0,18). Ни у одного пациента, получавшего ривароксабан и аспирин, не было серьезных побочных эффектов, которые привели к прекращению приема исследуемого препарата.
Выводы
Среди пациентов, госпитализированных по поводу инфекции COVID-19, ни колхицин, ни комбинация ривароксабана и аспирина не предотвращают прогрессирование заболевания или смерть.
Регистрация исследования
Исследование зарегистрировано на www.clinicaltrials.gov, NCT04324463 и продолжается.
Eikelboom JW, Jolly SS, Belley-Cote EP, Whitlock RP, Rangarajan S, Xu L, Heenan L, Bangdiwala SI, Luz Diaz M, Diaz R, Yusufali A, Kumar Sharma S, Tarhuni WM, Hassany M, Avezum A, Harper W, Wasserman S, Almas A, Drapkina O, Felix C, Lopes RD, Berwanger O, Lopez-Jaramillo P, Anand SS, Bosch J, Choudhri S, Farkouh ME, Loeb M, Yusuf S.
Lancet Respiratory Medicine, 2022 October, 10, available online
DOI: 10.1016/S2213−2600(22)00298−3
PMID: 36 228 641
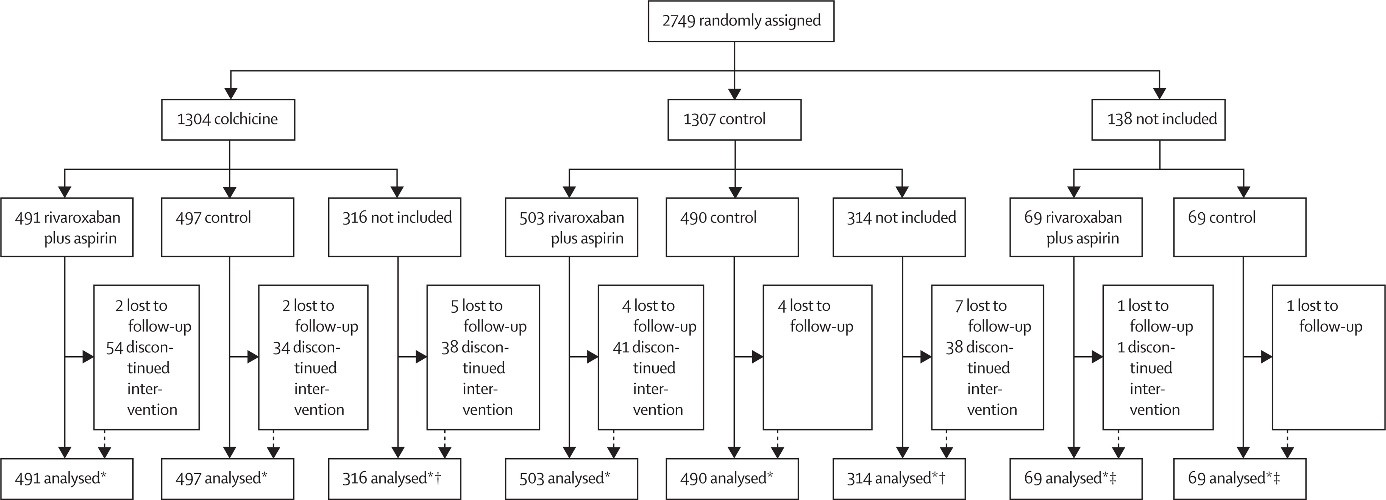
Figure 1. Trial profile
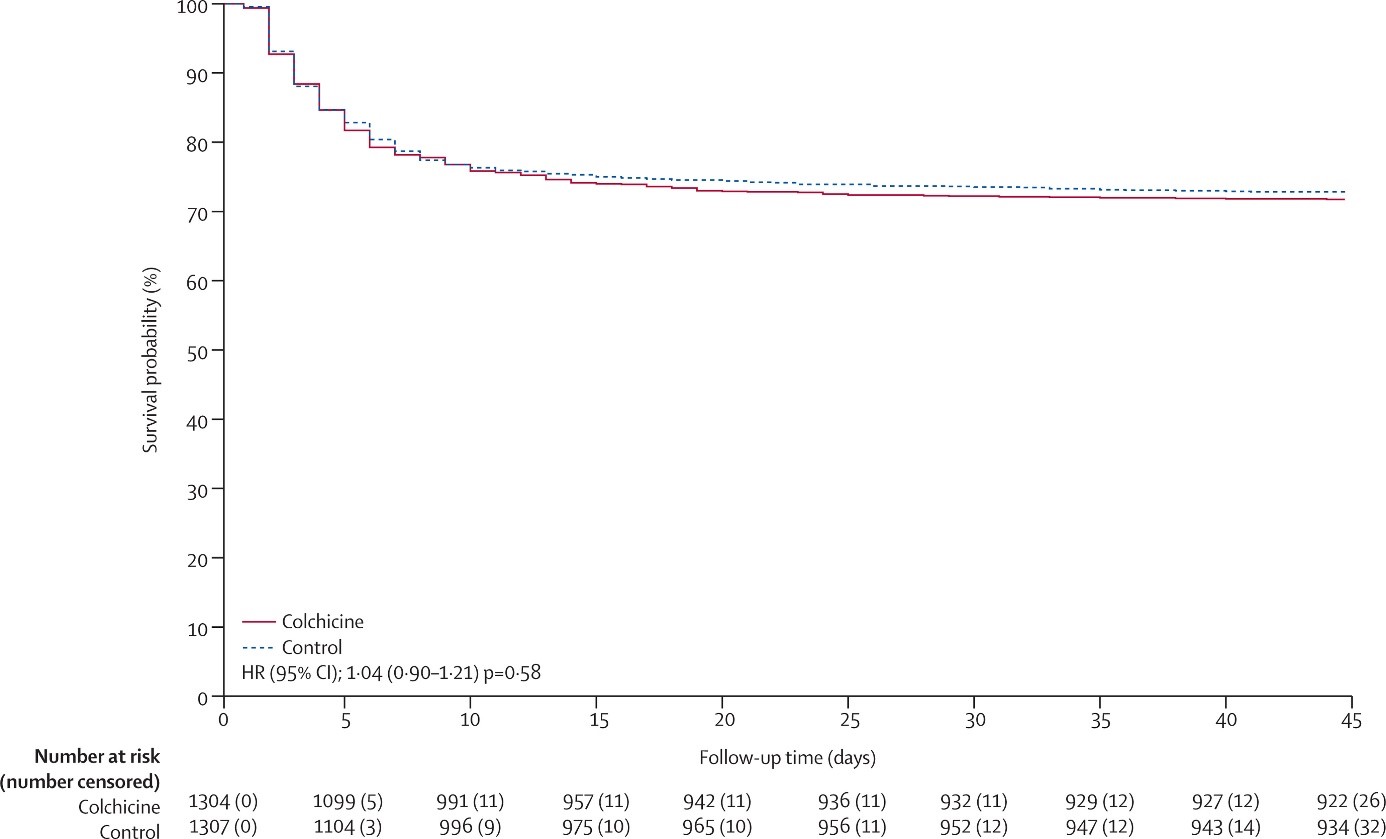
Figure 2. Kaplan Meier curve showing the effect of colchicine compared with control on the primary outcome of high flow oxygen, ventilation, or death
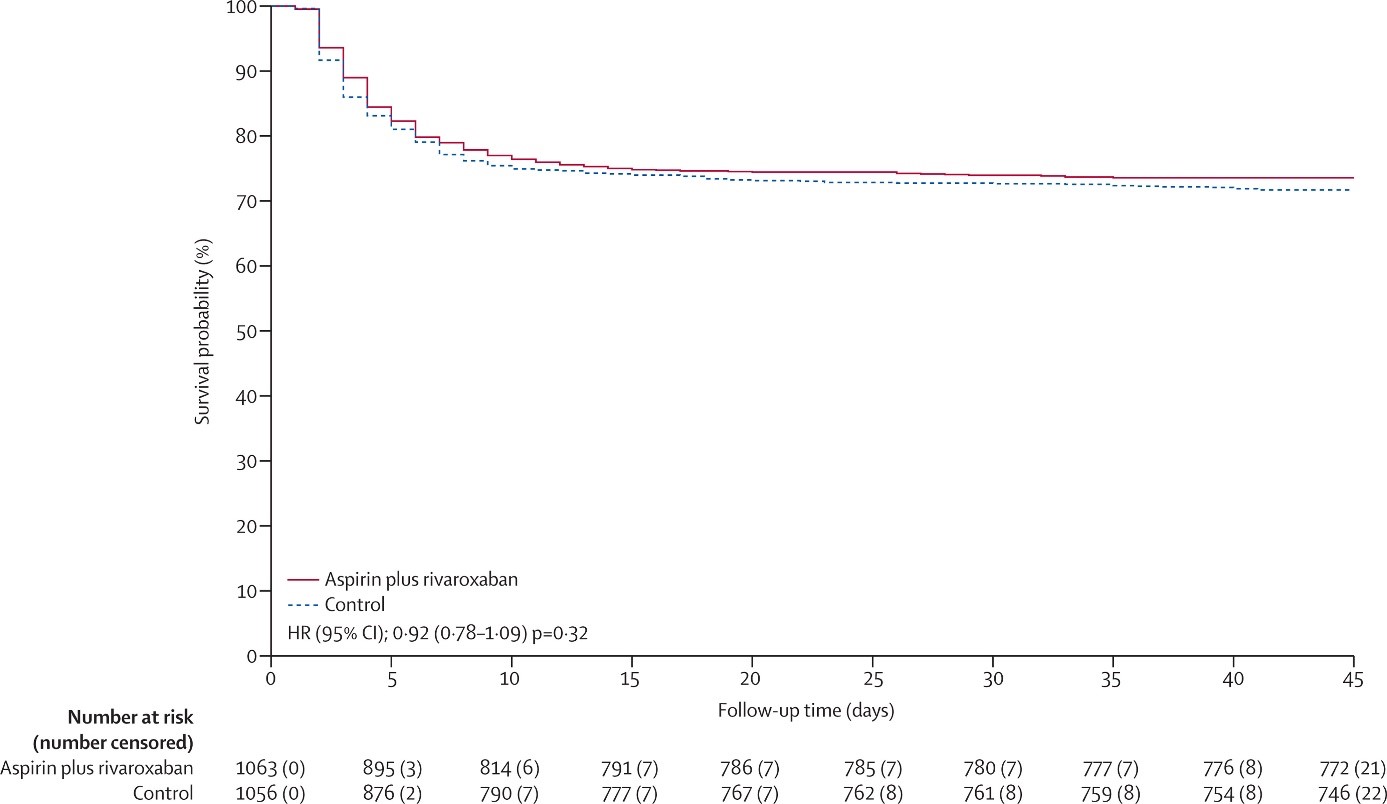
Figure 3. Kaplan-Meier curve showing the effect of rivaroxaban plus aspirin compared with control on the primary outcome of major thrombosis, high flow oxygen, ventilation, or death
Colchicine and the combination of rivaroxaban and aspirin in patients hospitalised with COVID-19 (ACT): an open-label, factorial, randomised, controlled trial
Background
COVID-19 disease is accompanied by a dysregulated immune response and hypercoagulability. The Anti Coronavirus Therapies (ACT) inpatient trial aimed to evaluate anti-inflammatory therapy with colchicine and antithrombotic therapy with the combination of rivaroxaban and aspirin for prevention of disease progression in patients hospitalised with COVID-19.
Methods
The ACT inpatient, open-label, 2×2 factorial, randomised, controlled trial was done at 62 clinical centers in 11 countries. Patients aged at least 18 years with symptomatic, laboratory confirmed COVID-19 who were within 72 h of hospitalisation or worsening clinically if already hospitalised were randomly assigned (1:1) to receive colchicine 1,2 mg followed by 0,6 mg 2 h later and then 0,6 mg twice daily for 28 days versus usual care; and in a second (1:1) randomisation, to the combination of rivaroxaban 2,5 mg twice daily plus aspirin 100 mg once daily for 28 days versus usual care. Investigators and patients were not masked to treatment allocation.
The primary outcome, assessed at 45 days in the intention-to-treat population, for the colchicine randomisation was the composite of the need for high-flow oxygen, mechanical ventilation, or death; and for the rivaroxaban plus aspirin randomisation was the composite of major thrombosis (myocardial infarction, stroke, acute limb ischemia, or pulmonary embolism), the need for high-flow oxygen, mechanical ventilation, or death.
Findings
Between Oct 2, 2020, and Feb 10, 2022, at 62 sites in 11 countries, 2749 patients were randomly assigned to colchicine or control and the combination of rivaroxaban and aspirin or to the control. 2611 patients were included in the analysis of colchicine (n=1304) versus control (n=1307); 2119 patients were included in the analysis of rivaroxaban and aspirin (n=1063) versus control (n=1056). Follow-up was more than 98% complete.
Overall, 368 (28,2%) of 1304 patients allocated to colchicine and 356 (27,2%) of 1307 allocated to control had a primary outcome (hazard ratio [HR] 1,04, 95% CI 0,90−1,21, p=0,58); and 281 (26,4%) of 1063 patients allocated to the combination of rivaroxaban and aspirin and 300 (28,4%) of 1056 allocated to control had a primary outcome (HR 0,92, 95% CI 0,78−1,09, p=0,32).
Results were consistent in subgroups defined by vaccination status, disease severity at baseline, and timing of randomisation in relation to onset of symptoms. There was no increase in the number of patients who had at least one serious adverse event for colchicine versus control groups (87 [6,7%] of 1304 vs 90 [6,9%] of 1307) or with rivaroxaban and aspirin versus control groups (85 [8·0%] vs 91 [8·6%]).
Among patients assigned to colchicine, 8 (0,61%) had adverse events that led to discontinuation of study drug, mostly gastrointestinal in nature. 17 (1,6%) patients assigned to the combination of rivaroxaban and aspirin had bleeding compared with seven (0,66%) of those allocated to control (p=0,042); the number of serious bleeding events was two (0,19%) versus six (0,57%), respectively (p=0,18). No patients assigned to rivaroxaban and aspirin had serious adverse events that led to discontinuation of study drug
Interpretation
Among patients hospitalised with COVID-19, neither colchicine nor the combination of rivaroxaban and aspirin prevent disease progression or death.
Trial registration
The trial is registered at www.clinicaltrials.gov, NCT04324463 and is ongoing.
