Рецепторы к белку системы комплемента C5a, выступающему в роли активатора опосредованного ИЛ-1 рекрутинга воспалительных клеток, новая потенциальная мишень в лечении подагрического артрита.
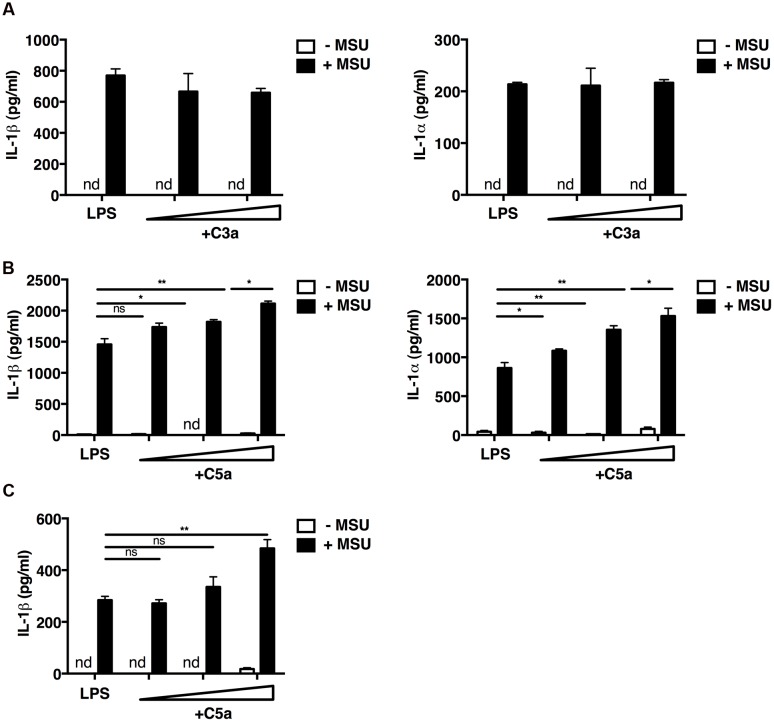
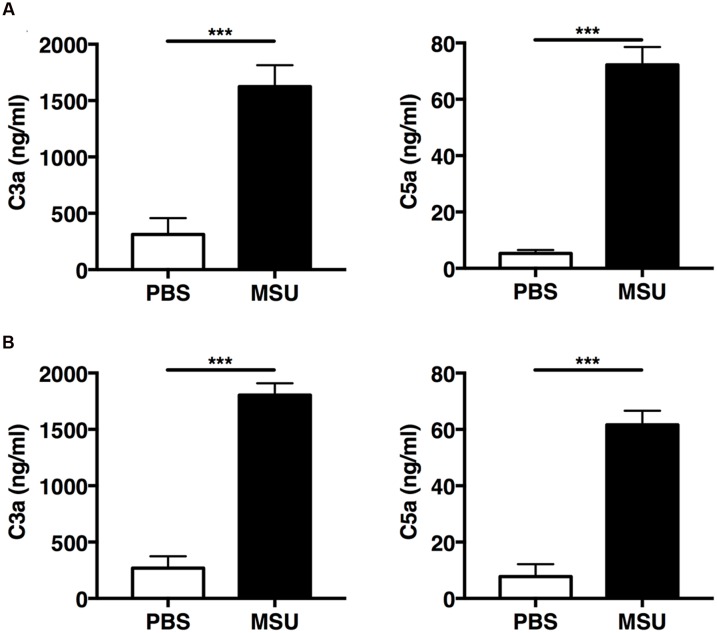
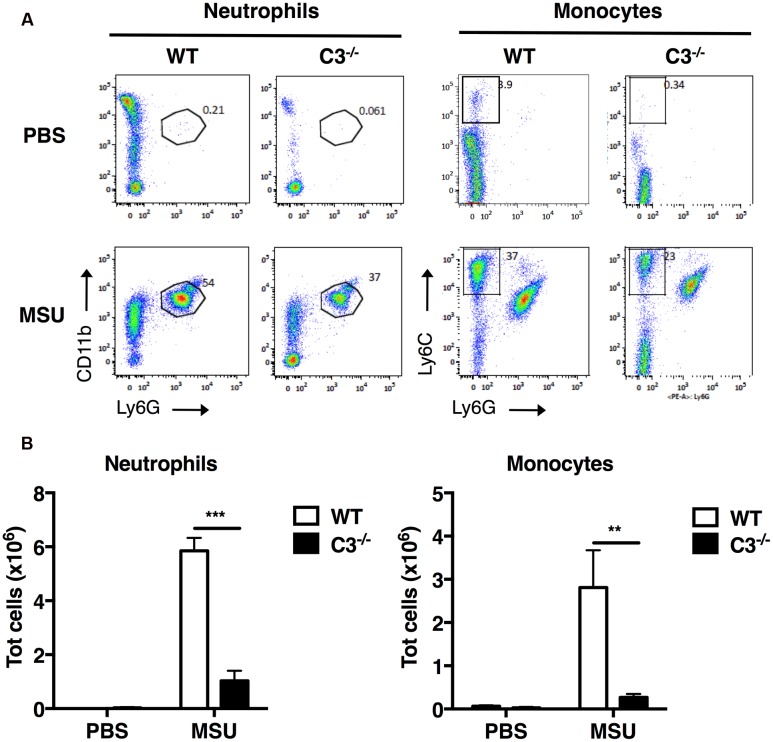
Подагрический артрит развивается вследствие отложения кристаллов моноурата натрия (МУН) в суставах. Кристаллы МУН вызывают острое воспаление, которое характеризуется массивной инфильтрацией нейтрофилами и моноцитами, мобилизуемых провоспалительным цитокином ИЛ-1β. Кристаллы МУН также активируют систему комплемента, которая регулирует воспалительный ответ. Однако неясно, связана ли опосредованная МУН активация комплемента с выбросом ИЛ-1β in vivo; также неизвестна роль, которую могут играть в процессе отдельные реакции системы комплемента. Было показано, что воздействие кристаллов МУН in vivo запускает каскад реакций, ведущий к образованию биологически активных белков комплемента C3a и C5a. C5a, но не C3a, усиливает выброс ИЛ-1β и ИЛ-1α из праймированных липополисахаридами и подвергшихся воздействию кристаллами МУН брюшинных макрофагов и человеческих моноцитов in vitro; in vivo белок C5a, индуцированный МУН, активировал рекрутинг мышиных нейтрофилов, а также синтез ИЛ-1β в месте воспаления. Эти эффекты существенно снижались при введении мышам антагониста рецепторов C5a. Исследования механизмов показатели, что C5a с большей вероятностью усиливали активацию инфламмасом NLRP3 посредством активных форм кислорода (АФК), а не путем повышенной транскрипции компонентов инфламмасомы. Был сделал вывод, что C5a, синтезируемый вследствие активации системы комплемента моноуратом натрия, in vivo усиливает рекрутинг нейтрофилов и синтез ИЛ-1 через образование АФК, которые активируют инфламмасому NLRP3. Признание рецептора к C5a основным активатором опосредованного ИЛ-1 рекрутинга воспалительных клеток дает нам новую потенциальную мишень для лечения подагрического артрита.

Khameneh HJ, Ho AW, Laudisi F, Derks H, Kandasamy M, Sivasankar B, Teng GG, Mortellaro A
Frontiers Pharmacology. 2017 Jan 23
Pubmed: 28167912
DOI: 10.1371/journal.pone.0168784
![]()
C5a Regulates IL-1β Production and Leukocyte Recruitment in a Murine Model of Monosodium Urate Crystal-Induced Peritonitis.
Gouty arthritis results from the generation of monosodium urate (MSU) crystals within joints. These MSU crystals elicit acute inflammation characterized by massive infiltration of neutrophils and monocytes that are mobilized by the pro-inflammatory cytokine IL-1β. MSU crystals also activate the complement system, which regulates the inflammatory response; however, it is unclear whether or how MSU-mediated complement activation is linked to IL-1β release in vivo, and the various roles that might be played by individual components of the complement cascade. Here we show that exposure to MSU crystals in vivo triggers the complement cascade, leading to the generation of the biologically active complement proteins C3a and C5a. C5a, but not C3a, potentiated IL-1β and IL-1α release from LPS-primed MSU-exposed peritoneal macrophages and human monocytic cells in vitro; while in vivo MSU-induced C5a mediated murine neutrophil recruitment as well as IL-1β production at the site of inflammation. These effects were significantly ameliorated by treatment of mice with a C5a receptor antagonist. Mechanistic studies revealed that C5a most likely increased NLRP3 inflammasome activation via production of reactive oxygen species (ROS), and not through increased transcription of inflammasome components. Therefore we conclude that C5a generated upon MSU-induced complement activation increases neutrophil recruitment in vivo by promoting IL-1 production via the generation of ROS, which activate the NLRP3 inflammasome. Identification of the C5a receptor as a key determinant of IL-1-mediated recruitment of inflammatory cells provides a novel potential target for therapeutic intervention to mitigate gouty arthritis.